冷冻电镜(cryo-EM)单颗粒分析技术已经成为结构生物学众多结构解析方法中异军突起的一支,在膜蛋白的结构解析中更是发挥着与日俱增的作用。目前的冷冻电镜单颗粒技术已经能较容易地将分子量大于300千道尔顿且生化性质稳定的蛋白质解析至近原子分辨率(约3 埃水平)。但由于小分子量蛋白质(一般为小于200千道尔顿)颗粒在冷冻样品中衬度不足等原因,小分子量蛋白质的高分辨解析工作对目前的技术手段而言仍然是很大的挑战。
清华大学王宏伟教授团队研发利用球差校正器-电压相位板联用冷冻电镜成像系统,大幅度地提升了蛋白质颗粒在照片中的衬度,同时又保存了足够多的高分辨率结构信息用于后期三维重构。在此基础上,利用自主研制的单层大单晶石墨烯载网来冷冻蛋白质样品,使得吸附在亲水化石墨烯表面的蛋白分子免于气液界面造成的分子结构变化,保存了更完整的结构信息。结合两种技术的优势,分别得到了分子量大小为52千道尔顿的链霉亲和素蛋白,以及在结合与未结合小分子生物素两种状态的近原子分辨率结构,创造了利用单颗粒技术解析近原子分辨率蛋白结构的分子量最小值新纪录,拓展了该技术的应用极限。
这一重要研究成果不仅提供了现有单颗粒样品中气液界面对蛋白分子颗粒性质影响的关键证据,对传统理论进行了有力的补充,还为未来方法学的发展起到了积极的推动作用,研究成果2019年6月3日在《自然·通讯》杂志在线发表。
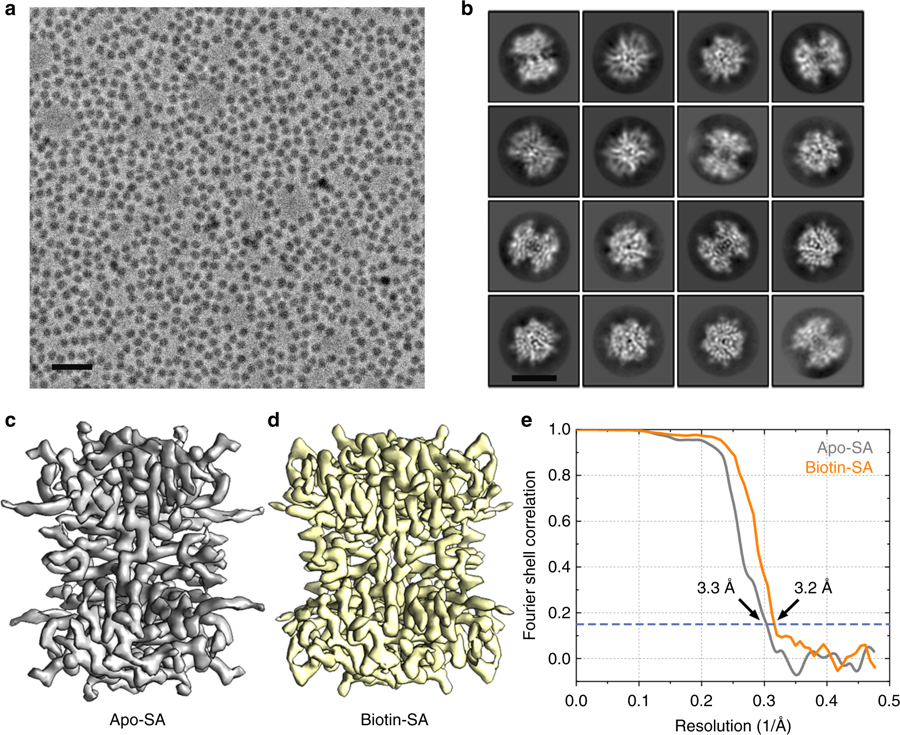
52 kDa链霉亲和素蛋白原始数据及三维重构示意图
